Wyzwanie:
Optymalizacja leczenia wolumetrycznego pacjentów z ARDS
Życie Twoich ciężko chorych pacjentów zależy od tego, czy trafnie określisz kolejny krok leczenia. W przypadku ARDS kwestia ta staje się tym bardziej kluczowa, ponieważ uszkodzone płuca posiadają zwiększoną przesiąkliwość, co w rezultacie skutkuje ich obrzękiem. W związku z powyższym kluczowe staje się jak najwcześniejsze uzyskanie pełnego obrazu stanu hemodynamicznego pacjenta w celu zastosowania odpowiedniej terapii. Szybkość leczenia wpływa na jego wyniki.
Czy potrafimy mierzyć obrzęk płuc?
W ciągu ostatnich 2 dekad obserwowano wdrażanie i rozwój techniki termodylucji przezpłucnej (TPTD).[1] Umożliwia ona określenie obrzęku płucnego na podstawie wskaźnika pozanaczyniowej wody płucnej (ELWI) i wskaźnika przepuszczalności naczyń płucnych (PVPI). PVPI umożliwia diagnozowanie różnicowe pochodzenia obrzęku płuc, tj. kardiogennego lub zapalnego. ELWI i PVPI można stosować jako kryteria określające ryzyko związane z podawaniem płynów.[2]
Pozanaczyniowa woda płucna stanowi nagromadzenie płynu w tkance płucnej i/lub pęcherzykach płucnych. Wskaźnik przepuszczalności naczyń płucnych (PVPI) stanowi pośrednie odzwierciedlenie integralności bariery pęcherzykowo-włośniczkowej.
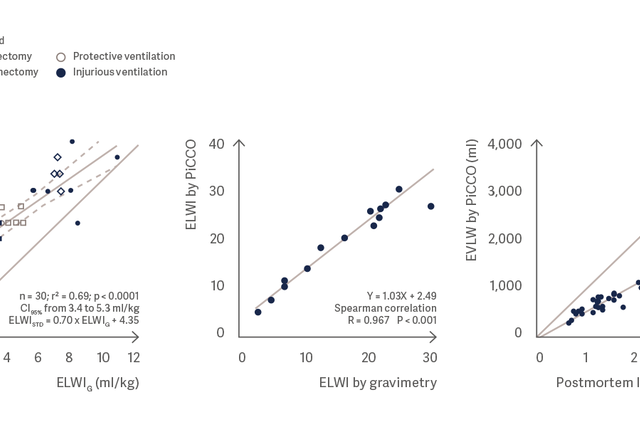
Pomiar ilości wody znajdującej się w płucach przy użyciu PiCCO bardzo dobrze koreluje z grawimetrycznym pomiarem wody obecnej w płucach i pośmiertną masą płuc. [3], [4], [5]
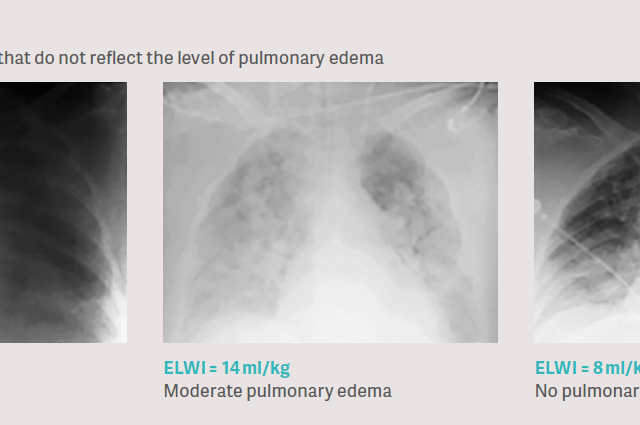
Problem kliniczny: prześwietlenie klatki piersiowej nie odzwierciedla w sposób wiarygodny stopnia obrzęku płuc
Typowym klinicznym podejściem w przypadku szacowania obrzęku płuc jest ocena zdjęć rentgenowskich klatki piersiowej. Jest to jednak niezwykle trudne ze względu na fakt, iż prześwietlenie klatki piersiowej jest pomiarem gęstości, na które wpływają wszystkie przedziały klatki piersiowej, takie jak kości, mięśnie, warstwy tkanek, krew, naczynia krwionośne, powietrze, obrzęk tkanek, płyn w jamie opłucnej oraz ewentualnie sam obrzęk płuc. W związku z powyższym w badaniach klinicznych wykazano, iż ocena rentgenowska klatki piersiowej pod kątem obrzęku płuc jest bardzo niedokładna w porównaniu z bezpośrednią oceną ilościową metodą termodylucji przezpłucnej.[6], [7], [8].
Obrzęk płuc kardiogenny czy zapalny?
PVPI stanowi pośrednie odzwierciedlenie integralności
bariery pęcherzykowo-włośniczkowej. Jest ono obliczane na podstawie stosunku EWLI do objętości krwi w płucach (PBV), wskaźnika objętości płynu wydostającego się z naczyń do objętości płynu, który pozostaje w naczyniach.[9]
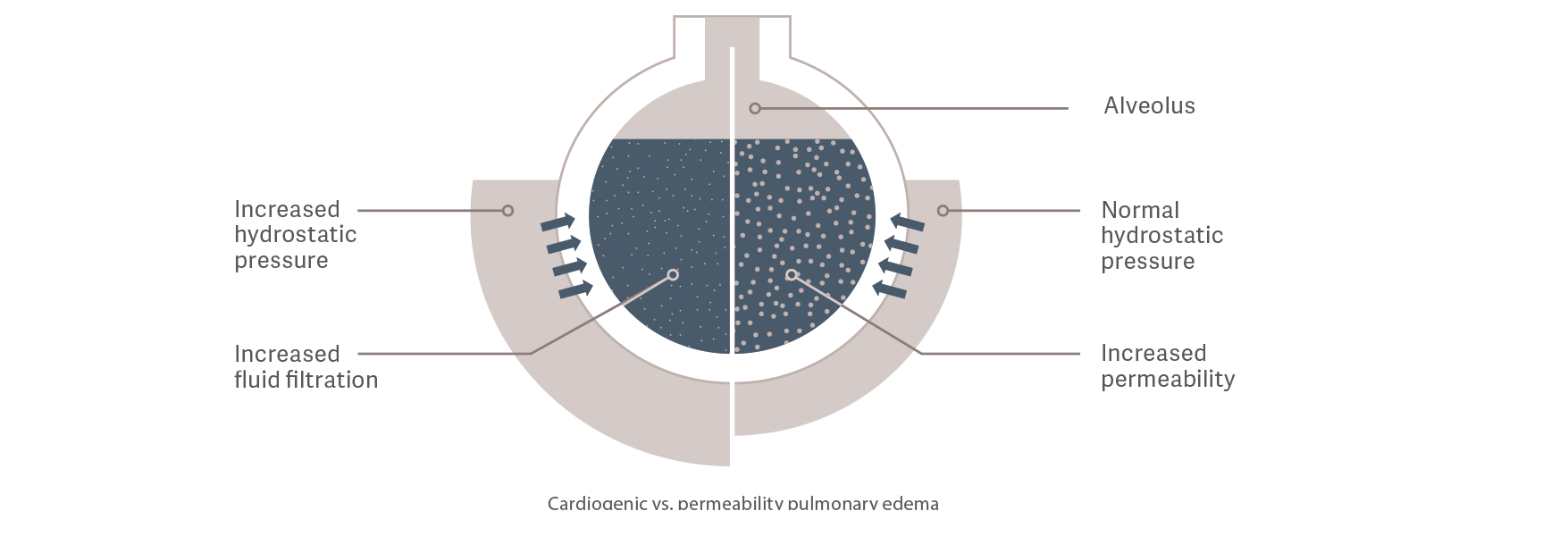
Obrzęk płucny kardiogenny
Ciśnienie hydrostatyczne wzrasta w wyniku wewnątrznaczyniowego przeciążenia płynem.
Powoduje to wyciek płynów do przestrzeni pozanaczyniowej.
Zapalny obrzęk płuc
Przepuszczalność naczyniowa zwiększa się w wyniku reakcji zapalnej wywoływanej, na przykład, sepsą. Prowadzi to do zwiększonego przepływu płynów, elektrolitów
i białek z przestrzeni wewnątrznaczyniowej do przestrzeni pozanaczyniowej, nawet
przy normalnym lub niskim stanie płynu wewnątrznaczyniowego i ciśnieniu hydrostatycznym.
Korzyści kliniczne wynikające z połączenia ELWI i PVPI
Konieczność rozpoznania i oceny obrzęku płuc w odniesieniu do skomplikowanych przypadków, takich jak ARDS, również może wpłynąć na wyniki leczenia. Znaczący obrzęk płuc pogarsza wymianę gazów oddechowych, powodując tym samym niewydolność oddechową. Parametry ELWI i PVPI można wykorzystać do dokładnej oceny ilościowej obrzęku płuc bezpośrednio przy łóżku pacjenta. Pozwala to również na ocenę stopnia nasilenia ARDS.[2]
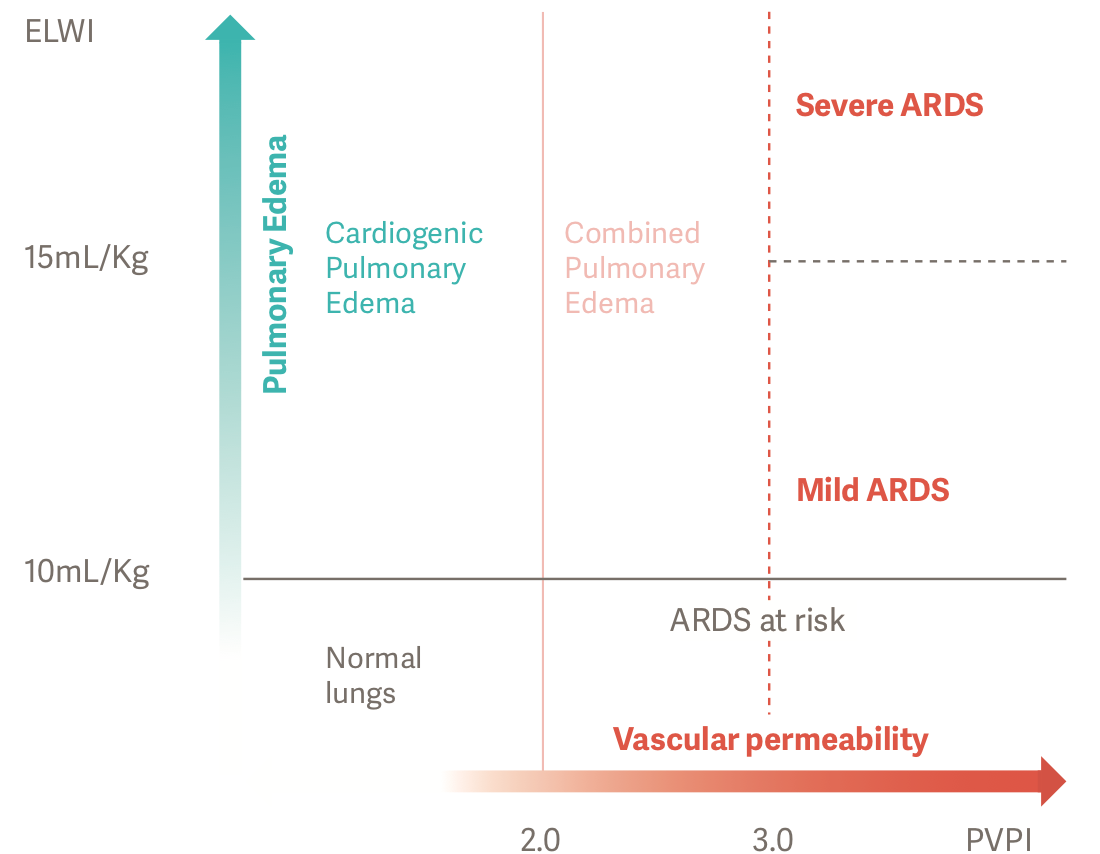
Dzięki zastosowaniu metody ELWI i PVPI możliwe jest postawienie dokładnej i obiektywnej diagnozy pacjentów z ARDS. PVPI powyżej 3 przy ELWI przekraczającym 10 ml/kg oznacza obrzęk płuc powiązany ze zwiększoną przesiąkliwością lub ARDS.[2]
Poprawa wyników dzięki leczeniu ARDS w oparciu o PiCCO
W przypadku ARDS badania sugerują, iż leczenie oparte na protokołach, w tym pomiarach ELWI, jest bezpieczne, prowadzi do obniżenia skumulowanego bilansu płynów, zmniejszenia śmiertelności na oddziałach intensywnej opieki medycznej i skrócenia czasu prowadzenia wentylacji mechanicznej, pobytu na oddziale intensywnej opieki medycznej oraz obniżenia kosztów leczenia.[10]
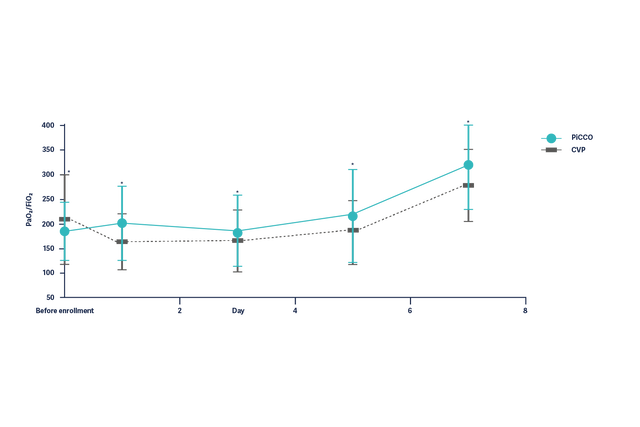
Poprawa natlenienia (PaO2/FiO2) u pacjentów z ARDS w ciągu 7 dni jest znacznie lepsza w przypadku pacjentów, u których zastosowano leczenie hemodynamiczne oparte na parametrach PiCCO.